C2H6O
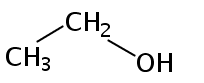
1.化学性质:乙醇是醇类的代表物质,化学性质如下所示。
① 生成金属衍生物乙醇与钠、钾等碱金属反应生成乙醇化物;低级醇容易发生此反应,有时有着火的危险
2C2H5OH + 2Na→2C2H5ONa + H2
高级醇反应较慢,特别是高级仲醇、叔醇反应速度小,不容易生成醇化物;铝、镁、钙、钡等金属与醇一起煮沸,也能生成醇化物。
② 生成酯醇与有机酸、无机酸反应时脱水生成酯,反应是可逆的
C2H5OH + RCOOH→RCOOC2H5 + H2O
此反应常用强酸、金属盐、离子交换树脂等作催化剂;甲醇的反应性最大,C2~C5的伯醇反应速度大致相等;仲醇、叔醇的反应性小,而且叔醇在酸性介质中容易脱水生成烯烃,一般用间接的方法制备叔醇的酯;酰氯和酸酐与醇更易进行酯化反应。
③ 生成卤代烷乙醇与卤代氢、亚硫酰氯或卤化磷反应时,羟基被卤原子置换,生成卤代烷。
叔醇的反应速度最快,仲醇、伯醇的反应速度依次降低;卤化氢以碘化氢最快,氯化氢最慢。
④ 脱水反应醇的脱水有分子间脱水和分子内脱水两种方式;分子间脱水生成醚,分子内脱水生成烯烃。反应按哪种方式进行取决于醇的结构和反应条件;一般高温有利于生成烯烃,低温有利于生成醚;叔醇易脱水成烯,难以得到醚;反应常在催化剂存在下进行,常用的催化剂有硫酸、磷酸、三氧化二铝、磷酸铝等。
⑤ 缩醛的生成乙醇在室温下与醛反应生成半缩醛,并放出热量。在酸性催化剂如HCl、H2SO4或CaCl2存在下,进一步与1mol醇反应生成缩醛。
⑥ 氧化反应伯醇氧化生成醛,醛再继续氧化成羧酸。仲醇氧化生成酮。叔醇难氧化,但在剧烈的条件下氧化生成碳原子数较叔醇少的产物。常用的氧化剂有重铬酸钠、硫酸或三氧化铬和冰乙酸。乙醇氧化生成乙醛或乙酸。
⑦ 脱氢反应伯醇或仲醇的蒸气在高温下通过脱氢催化剂如铜、银、镍或铜氧化铬时,则脱氢生成醛或酮。叔醇不能脱氢,只能脱水成烯烃。
⑧ 其他乙醇易与乙烯酮、环氧乙烷、异氰酸酯等反应性大的物质发生反应,分别生成乙酸酯、烷氧基醇和氨基甲酸乙酯;乙醇用漂白粉溶液氧化生成氯仿,用碘和氢氧化钾氧化生成碘仿;与不含亚硝酸的硝酸作用生成硝酸乙酯;与汞和过量的硝酸作用生成雷酸汞Hg(ONC)2;与氧化汞和氢氧化钠一起加热生成爆炸性物质C2Hg6O4H2。
2.与铬酸、次氯酸钙、过氧化氢、硝酸、硝酸铂、过氮酸盐及氧化剂反应剧烈,有发生爆炸的危险。易挥发,极易燃烧,火焰淡蓝色。蒸气与空气能形成爆炸混合物,爆炸极限4.3%~19.0%(vol)。具有吸湿性,与水形成共沸混合物。微毒。
3.稳定性[26] 稳定
4.禁配物[27] 强氧化剂、酸类、酸酐、碱金属、胺类
5.聚合危害[28] 不聚合
1.性状:无色液体,有酒香。[1]
2.熔点(℃):-114.1[2]
3.沸点(℃):78.3[3]
4.相对密度(水=1):0.79(20℃)[4]
5.相对蒸气密度(空气=1):1.59[5]
6.饱和蒸气压(kPa):5.8(20℃)[6]
7.燃烧热(kJ/mol):-1365.5[7]
8.临界温度(℃):243.1[8]
9.临界压力(MPa):6.38[9]
10.辛醇/水分配系数:0.32[10]
11.闪点(℃):13(CC);17(OC)[11]
12.引燃温度(℃):363[12]
13.爆炸上限(%):19.0[13]
14.爆炸下限(%):3.3[14]
15.溶解性:与水混溶,可混溶于乙醚、氯仿、甘油、甲醇等多数有机溶剂。[15]
16.黏度(mPa·s,15ºC):0.6405
17.黏度(mPa·s,20ºC):0.5945
18.黏度(mPa·s,25ºC):0.5525
19.黏度(mPa·s,30ºC):0.5142
20.闪点(ºC,开口):16.0
21.闪点(ºC,闭口):14.0
22.蒸发热(KJ/mol,b.p.):38.95
23.熔化热(KJ/kg):104.7
24.生成热(KJ/mol,液体):-277.8
25.比热容(KJ/(kg·K),20ºC,定压):2.42
26.沸点上升常数:1.03~1.09
27.电导率(S/m):1.35×10-19
28.热导率(W/(m·K)):18.00
29.体膨胀系数(K-1,20ºC):0.00108
30.临界密度(g·cm-3):0.275
31.临界体积(cm3·mol-1):168
32.临界压缩因子:0.241
33.偏心因子:0.637
34.Lennard-Jones参数(A):4.5564
35.Lennard-Jones参数(K):424.51
36.溶度参数(J·cm-3)0.5:26.421
37.van der Waals面积(cm2·mol-1):4.930×109
38.van der Waals体积(cm3·mol-1):31.940
39.气相标准燃烧热(焓)(kJ·mol-1):1410.01
40.气相标准声称热(焓)( kJ·mol-1) :-234.01
41.气相标准熵(J·mol-1·K-1) :280.64
42.气相标准生成自由能( kJ·mol-1):-166.7
43.气相标准热熔(J·mol-1·K-1):65.21
44.液相标准燃烧热(焓)(kJ·mol-1):-1367.54
45.液相标准声称热(焓)( kJ·mol-1):-276.98
46.液相标准熵(J·mol-1·K-1) :161.04
47.液相标准生成自由能( kJ·mol-1):-174.18
48.液相标准热熔(J·mol-1·K-1):112.6
49.
1.化学性质:乙醇是醇类的代表物质,化学性质如下所示。
① 生成金属衍生物乙醇与钠、钾等碱金属反应生成乙醇化物;低级醇容易发生此反应,有时有着火的危险
2C2H5OH + 2Na→2C2H5ONa + H2
高级醇反应较慢,特别是高级仲醇、叔醇反应速度小,不容易生成醇化物;铝、镁、钙、钡等金属与醇一起煮沸,也能生成醇化物。
② 生成酯醇与有机酸、无机酸反应时脱水生成酯,反应是可逆的
C2H5OH + RCOOH→RCOOC2H5 + H2O
此反应常用强酸、金属盐、离子交换树脂等作催化剂;甲醇的反应性最大,C2~C5的伯醇反应速度大致相等;仲醇、叔醇的反应性小,而且叔醇在酸性介质中容易脱水生成烯烃,一般用间接的方法制备叔醇的酯;酰氯和酸酐与醇更易进行酯化反应。
③ 生成卤代烷乙醇与卤代氢、亚硫酰氯或卤化磷反应时,羟基被卤原子置换,生成卤代烷。
叔醇的反应速度最快,仲醇、伯醇的反应速度依次降低;卤化氢以碘化氢最快,氯化氢最慢。
④ 脱水反应醇的脱水有分子间脱水和分子内脱水两种方式;分子间脱水生成醚,分子内脱水生成烯烃。反应按哪种方式进行取决于醇的结构和反应条件;一般高温有利于生成烯烃,低温有利于生成醚;叔醇易脱水成烯,难以得到醚;反应常在催化剂存在下进行,常用的催化剂有硫酸、磷酸、三氧化二铝、磷酸铝等。
⑤ 缩醛的生成乙醇在室温下与醛反应生成半缩醛,并放出热量。在酸性催化剂如HCl、H2SO4或CaCl2存在下,进一步与1mol醇反应生成缩醛。
⑥ 氧化反应伯醇氧化生成醛,醛再继续氧化成羧酸。仲醇氧化生成酮。叔醇难氧化,但在剧烈的条件下氧化生成碳原子数较叔醇少的产物。常用的氧化剂有重铬酸钠、硫酸或三氧化铬和冰乙酸。乙醇氧化生成乙醛或乙酸。
⑦ 脱氢反应伯醇或仲醇的蒸气在高温下通过脱氢催化剂如铜、银、镍或铜氧化铬时,则脱氢生成醛或酮。叔醇不能脱氢,只能脱水成烯烃。
⑧ 其他乙醇易与乙烯酮、环氧乙烷、异氰酸酯等反应性大的物质发生反应,分别生成乙酸酯、烷氧基醇和氨基甲酸乙酯;乙醇用漂白粉溶液氧化生成氯仿,用碘和氢氧化钾氧化生成碘仿;与不含亚硝酸的硝酸作用生成硝酸乙酯;与汞和过量的硝酸作用生成雷酸汞Hg(ONC)2;与氧化汞和氢氧化钠一起加热生成爆炸性物质C2Hg6O4H2。
2.与铬酸、次氯酸钙、过氧化氢、硝酸、硝酸铂、过氮酸盐及氧化剂反应剧烈,有发生爆炸的危险。易挥发,极易燃烧,火焰淡蓝色。蒸气与空气能形成爆炸混合物,爆炸极限4.3%~19.0%(vol)。具有吸湿性,与水形成共沸混合物。微毒。
3.稳定性[26] 稳定
4.禁配物[27] 强氧化剂、酸类、酸酐、碱金属、胺类
5.聚合危害[28] 不聚合
1.性状:无色液体,有酒香。[1]
2.熔点(℃):-114.1[2]
3.沸点(℃):78.3[3]
4.相对密度(水=1):0.79(20℃)[4]
5.相对蒸气密度(空气=1):1.59[5]
6.饱和蒸气压(kPa):5.8(20℃)[6]
7.燃烧热(kJ/mol):-1365.5[7]
8.临界温度(℃):243.1[8]
9.临界压力(MPa):6.38[9]
10.辛醇/水分配系数:0.32[10]
11.闪点(℃):13(CC);17(OC)[11]
12.引燃温度(℃):363[12]
13.爆炸上限(%):19.0[13]
14.爆炸下限(%):3.3[14]
15.溶解性:与水混溶,可混溶于乙醚、氯仿、甘油、甲醇等多数有机溶剂。[15]
16.黏度(mPa·s,15ºC):0.6405
17.黏度(mPa·s,20ºC):0.5945
18.黏度(mPa·s,25ºC):0.5525
19.黏度(mPa·s,30ºC):0.5142
20.闪点(ºC,开口):16.0
21.闪点(ºC,闭口):14.0
22.蒸发热(KJ/mol,b.p.):38.95
23.熔化热(KJ/kg):104.7
24.生成热(KJ/mol,液体):-277.8
25.比热容(KJ/(kg·K),20ºC,定压):2.42
26.沸点上升常数:1.03~1.09
27.电导率(S/m):1.35×10-19
28.热导率(W/(m·K)):18.00
29.体膨胀系数(K-1,20ºC):0.00108
30.临界密度(g·cm-3):0.275
31.临界体积(cm3·mol-1):168
32.临界压缩因子:0.241
33.偏心因子:0.637
34.Lennard-Jones参数(A):4.5564
35.Lennard-Jones参数(K):424.51
36.溶度参数(J·cm-3)0.5:26.421
37.van der Waals面积(cm2·mol-1):4.930×109
38.van der Waals体积(cm3·mol-1):31.940
39.气相标准燃烧热(焓)(kJ·mol-1):1410.01
40.气相标准声称热(焓)( kJ·mol-1) :-234.01
41.气相标准熵(J·mol-1·K-1) :280.64
42.气相标准生成自由能( kJ·mol-1):-166.7
43.气相标准热熔(J·mol-1·K-1):65.21
44.液相标准燃烧热(焓)(kJ·mol-1):-1367.54
45.液相标准声称热(焓)( kJ·mol-1):-276.98
46.液相标准熵(J·mol-1·K-1) :161.04
47.液相标准生成自由能( kJ·mol-1):-174.18
48.液相标准热熔(J·mol-1·K-1):112.6
49.
1.急性毒性[16]
LD50:7060mg/kg(大鼠经口);7060mg/kg(兔经口);7430mg/kg(兔经皮)
LC50:20000ppm(大鼠吸入,10h)
2.刺激性[17]
家兔经皮:20mg(24h),中度刺激。
家兔经验:500mg,重度刺激。
3.亚急性与慢性毒性[18] 大鼠经口10.2g/(kg·d),12周,体重下降,脂肪肝。
4.致突变性[19] 微生物致突变:鼠伤寒沙门菌11%。显性致死试验:小鼠经口1~1.5g/kg(每天,2周)阳性。细胞遗传学分析:人淋巴细胞2.5%(24h)。姐妹染色单体交换:人淋巴细胞500ppm(72h)。DNA抑制:人淋巴细胞220mmol/L。微核试验:狗淋巴细胞,400μmol/L。
5.致畸性[20] 猴孕后2~17周经口给予最低中毒剂量(TDLo)32400mg/kg,致中枢神经系统和颅面部(包括鼻、舌)发育畸形。大鼠、小鼠、豚鼠、家畜孕后不同时间经口、静脉内、腹腔内途径给予不同剂量,致中枢神经系统、泌尿生殖系统、内分泌系统、肝胆管系统、呼吸系统、颅面部(包括鼻、舌)、眼、耳发育畸形。雄性大鼠交配前30d经口给予240g/kg,致泌尿生殖系统发育畸形。
6.致癌性[21] IARC致癌性评论:对动物致癌性证据有限。
7.其他[22] 小鼠腹腔最低中毒剂量(TDLo):7.5g/kg(孕9d),致畸阳性。
1.生态毒性[23]
LC50:13g/L(96h)(虹鳟鱼,静态);14.2~15.3g/L(96h)(黑头呆鱼);9268~14221mg/L(48h)(水蚤,静态)
IC50:1450mg/L(72h)(藻类)
2.生物降解性[24]
好氧生物降解性(h):6.5~26
厌氧生物降解性(h):26~104
3.非生物降解性[25]
水中光氧化半衰期(h):8020~3.20×105
空气中光氧化半衰期(h):12.2~122
| 第一部分:化学品名称 |
1、摩尔折射率:12.84
2、摩尔体积(cm3/mol):59.0
3、等张比容(90.2K):128.4
4、表面张力(dyne/cm):22.3
5、极化率(10-24cm3):5.09
1.疏水参数计算参考值(XlogP):-0.1
2.氢键供体数量:1
3.氢键受体数量:1
4.可旋转化学键数量:0
5.互变异构体数量:无
6.拓扑分子极性表面积20.2
7.重原子数量:3
8.表面电荷:0
9.复杂度:2.8
10.同位素原子数量:0
11.确定原子立构中心数量:0
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1